Металлы побочных подгрупп
презентация к уроку на тему
Презентация по d-элементам
Скачать:
| Вложение | Размер |
|---|---|
| Металлы побочных подргупп | 1.09 МБ |
Предварительный просмотр:
Подписи к слайдам:
Подгруппа меди (медь, серебро, золото) Подгруппа цинка (цинк, кадмий, ртуть) Переходные металлы (хром, марганец, молибден, вольфрам и др.) Подгруппа железа (железо, кобальт, никель) Платиновая группа (рутений, родий, палладий, осмий, иридий, платина) Металлы побочных подгрупп
Особенностью является наличие заполненного предвнешнего d- подуровня, достигаемое за счёт перескока электрона с внешнего s-подуровня. Причина такого явления заключается в высокой устойчивости полностью заполненного d-подуровня. Подгруппа меди. Cu, Ag Серебро Ag [ Kr ] 4d 10 5s 1 0, +1, +3 Медь Cu [Ar] 3d 10 4s 1 0, +1, +2
при 400–500°С : 2Cu + O 2 = 2CuO; при 1000°С : 4Cu + O 2 = 2Cu 2 O при 400°С : Cu + S = CuS ; при выше 400°С : 2Cu + S = Cu 2 S при нагревании с фтором, хлором, бромом образуются галогениды меди (II) Cu + Br 2 = CuBr 2 с йодом – образуеся йодид меди (I): 2Cu + I 2 = 2CuI Медь не реагирует с водородом, азотом, углеродом и кремнием В присутствии углекислого газа и паров воды её поверхность покрывается зелёным налётом, представляющим собой основной карбонат меди(II) ( CuOH )2CO3 Химические свойства меди
Растворяется в разбавленной азотной кислоте: 3Cu + 8HNO 3 = 3Cu(NO 3 ) 2 + 2NO + 4H 2 O Реагирует с концентрированными кислотами-окислителями: Cu + 2H 2 SO 4 = CuSO 4 + SO 2 + 2H 2 O; Cu + 4HNO 3 = Cu (NO 3 ) 2 + 2NO 2 + 2H 2 O Медь растворяется в водном растворе аммиака в присутствии кислорода воздуха с образованием гидроксида тетраамминмеди (II): 2Cu + 8NH 3 + 2H 2 O + O 2 = 2[ Cu (NH 3 ) 4 ](OH) 2 . Медь окисляется оксидом азота ( IV) 2Cu + NO 2 = Cu 2 O + NO и хлоридом железа( III) Cu + 2FeCl 3 = CuCl 2 + 2FeCl 2 Химические свойства меди
Соли Cu2+ обычно окрашены в голубой или зеленоватый цвет. Образование нерастворимого гидроксида меди ( II ) голубого цвета: CuSO4+ 2NH4OH = Cu(OH)2 + (NH4)2SO4 Образование красно-бурого осадка гексациано феррата ( II ) меди Качественная реакция на Cu 2+ 2Cu 2+ + [Fe(CN) 6 ] 4− → Cu 2 [Fe(CN) 6 ]↓
При обычных условиях реагирует с серой, образуя сульфид серебра (I): 2Ag + S = Ag 2 S, при нагревании с галогенами образуются галогениды серебра (I): 2Ag + Br 2 = 2AgBr. Серебро не реагирует с кислородом, водородом, азотом, углеродом и кремнием. Растворяется в разбавленной азотной кислоте 3Ag + 4HNO 3 = 3AgNO 3 + NO + 2H 2 O Реагирует с концентрированными кислотами-окислителями: 2Ag + 2H 2 SO 4 = Ag 2 SO 4 + SO 2 + 2H 2 O; Ag +2HNO 3 = AgNO 3 + NO 2 + H 2 O. Химические свойства серебра
Образование белого творожистого осадка Ag+ + Cl — = AgCl ↓ , растворимого в гидрате аммиака AgCl + 2NH4OH = [Ag(NH3)2] Cl Образование красного осадка Ag+ + CrO4 — = AgCrO4↓ Образование желтого осадка Ag+ +PO4 3- = Ag3PO4 ↓ Образование белого-чернеющего осадка Ag+ + S2O3 2- = Ag2S2O3 ( разлагается) Качественная реакция на Ag +
Цинк [ Ar ] 3d 10 4s 2 хрупкий переходный металл голубовато-белого цвета (тускнеет на воздухе, покрываясь тонким слоем оксида цинка). Ртуть [ Xe ] 4f 14 5d 10 6s 2 один из двух химических элементов (и единственный металл), простые вещества которых при нормальных условиях находятся в жидком агрегатном состоянии Подгруппа цинка. Zn , Hg
На воздухе покрывается оксидной пленкой, при сильном нагреве горит голубоватым пламенем 2Zn + O 2 = 2ZnO При н.у. Zn + Cl 2 = ZnCl 2 С парами воды при температуре красного каления Zn + H 2 O = ZnO + H 2 Вытесняет водород из разбавленых кислот Zn + 2HCl = ZnCl 2 + H 2 С разбавленной HNO3 4Zn + 10HNO 3 = 4Zn(NO 3 ) 2 + NH 4 NO 3 + 3H 2 O С концентрированными кислотами-окислителями Zn + 2H 2 SO 4 = ZnSO 4 + SO 2 + 2H 2 O; Zn + 4HNO 3 = Zn(NO 3 ) 2 + 2NO 2 + 2H 2 O Химические свойства цинка
Типичный переходный элемент. Zn + 2H 2 SO 4 = ZnSO 4 + SO 2 + 2H 2 O; Zn + 4HNO 3 = Zn(NO 3 ) 2 + 2NO 2 + 2H 2 O Оксид цинка: ZnCO 3 = ZnO + CO 2 ZnO + 2HCl = ZnCl 2 + H 2 O; ZnO + 2NaOH + H 2 O = Na 2 [Zn(OH) 4 ]. Гидроксид цинка: ZnCl 2 + 2NaOH = Zn(OH) 2 + 2NaCl Zn(OH) 2 + H 2 SO 4 = ZnSO 4 + 2H 2 O; Zn(OH) 2 + 2NaOH = Na 2 [Zn(OH) 4 ] Zn(OH) 2 + 4NH 3 = [Zn(NH 3 ) 4 ](OH) 2 Химические свойства цинка
Образование нерастворимого основания Zn 2+ + 2OH — = Zn(OH)2↓ + 2OH- = [Zn(OH)4] 2- осадок белого цвета, растворимый в избытке щелочи Качественная реакция на Zn 2+
Эл. Конфигурация [ Ar ] 3d 5 4s 1 В свободном виде — голубовато-белый металл с кубической решеткой, один из самых твердых чистых металлов (уступает только бериллию, вольфраму и урану). Очень чистый хром достаточно хорошо поддаётся механической обработке. Хром
Оксид хрома (2) — СrО – твердое ярко – красное вещество, типичный основной оксид (ему соответствует гидроксид хрома (2) — Сr (ОН) 2 ), не растворяется в воде, но растворяется в кислотах: СrО + 2НСl = СrСl 2 + Н 2 О окисляется на воздухе: 4СrО+ О 2 = 2Сr 2 О 3 Гидроксид хрома (2) — Сr (ОН) 2 – вещество желтого цвета, плохо растворимо в воде, с ярко выраженным основным характером, поэтому взаимодействует с кислотами: Сr (ОН) 2 + Н 2 SО 4 = СrSO 4 + 2Н 2 О Соединения хрома Cr 2+
Наиболее устойчивая с.о. хрома. Оксид хрома (3) — Сr 2 О 3 нерастворим в воде, тугоплавкий, по твёрдости близок к корунду, имеет амфотерный характер, однако в кислотах и щелочах растворяется плохо. С концентрированными растворами кислот и щелочей взаимодействует с трудом: Сr 2 О 3 + 6 КОН + 3Н 2 О = 2К 3 [ Сr (ОН) 6 ] Сr 2 О 3 + 6НСl = 2СrСl 3 + 3Н 2 О Гидроксид хрома (3) Сr (ОН) 3 получают: СrСl 3 +3КОН = Сr (ОН) 3 ↓ + 3КСl Легко взаимодействует с кислотами и щелочами, т.е. проявляет амфотерные свойства: Сr (ОН) 3 + 3НNО 3 = Сr (NО 3 ) 3 + 3Н 2 О Сr (ОН) 3 + 3КОН = К 3 [ Сr (ОН) 6 ] Соединения хрома Cr 3+
Оксид хрома (6) — СrО 3 – темно – красное кристаллическое вещество, хорошо растворимо в воде, типичный кислотный оксид. Этому оксиду соответствует две кислоты: СrО 3 + Н 2 О = Н 2 СrО 4 (хромовая кислота – образуется при избытке воды) СrО 3 + Н 2 О =Н 2 Сr 2 О 7 ( дихромовая кислота – образуется при большой концентрации оксида хрома (3)). Оксид хрома (6) – очень сильный окислитель Соединения хрома Cr 6 +
В кислой среде раствора хроматы переходят в дихроматы: 2К 2 СrО 4 + Н 2 SО 4 = К 2 Сr 2 О 7 + К 2 SО 4 + Н 2 О В щелочной среде дихроматы переходят в хроматы: К 2 Сr 2 О 7 + 2КОН = 2К 2 СrО 4 + Н 2 О Хромат и дихромат Хроматы и их растворы имеют желтую окраску, дихроматы – оранжевую. Хромат — ионы СrО42- и дихромат – ионы Сr2О72- легко переходят друг в друга при изменении среды растворов
Окислительные свойства Cr 6+ Дихроматы – сильные окислители . Под действием восстановителей в кислой среде переходят в соли хрома (III) K 2 Cr 2 O 7 + 3Na 2 SO 3 + 4H 2 SO 4 = Cr 2 (SO 4 ) 3 + 3Na 2 SO 4 + K 2 SO 4 + 4H 2 O Качественные реакции на хромат-ион BaCrO 4 PbCrO 4 Ag 2 CrO 4
Электронная конфигурация [ Ar ] 3d 5 4s 2 Простое вещество марганец — металл серебристо-белого цвета. Наряду с железом и его сплавами относится к чёрным металлам . Известны пять аллотропных модификаций марганца Один из основных минералов марганца — пиролюзит (MnO 2 ) , родохрозит (марганцевый шпат, малиновый шпат) MnCO 3 Характерные степени окисления марганца: 0, +2, +3, +4, +6, +7 (+1, +5 мало характерны) Марганец
Степени окисления и соединения Алюминотермическим методом, восстанавливая оксид Mn2O3, образующийся при прокаливании пиролюзита: Получение марганца
Соли Mn 2+ MnCl2 MnSO4
Соединения Mn 4+
Соединения М n 7+
Кислая среда Нейтральная среда Щелочная среда Окислительные свойства перманганата, в зависимости от среды реакции
Презентация на тему «Металлы побочных подгрупп»

Презентация на тему «Металлы побочных подгрупп»
Просмотр содержимого документа
«Презентация на тему «Металлы побочных подгрупп»»

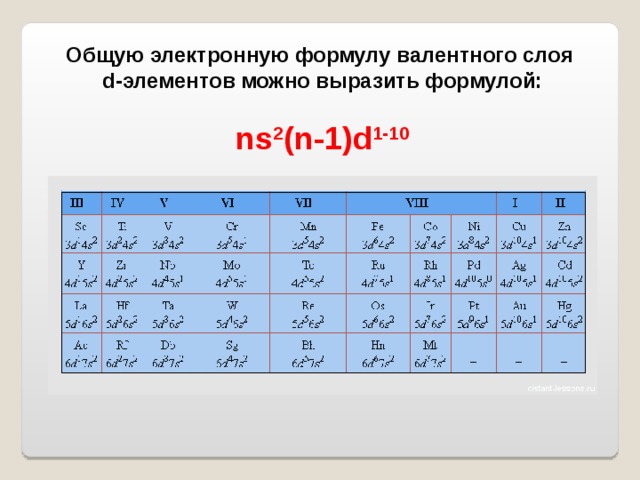
В периодической системе d-элементы или переходные металлы расположены в побочных подгруппах (или В подгруппах) всех восьми групп.
Это элементы, которые при образовании соединений имеют незаполненную d- орбиталь.
Под определение не подпадают скандий ( 3d 0 в соединениях) и цинк (3 d 10 в соединениях ) ; медь же входит в группу указанных соединений, если имеет в них конфигурацию 3 d 9 .
Принято, однако, относить эти металлы к d- металлам на основании химического сходства их соединений.
Общую электронную формулу валентного слоя
d-элементов можно выразить формулой:
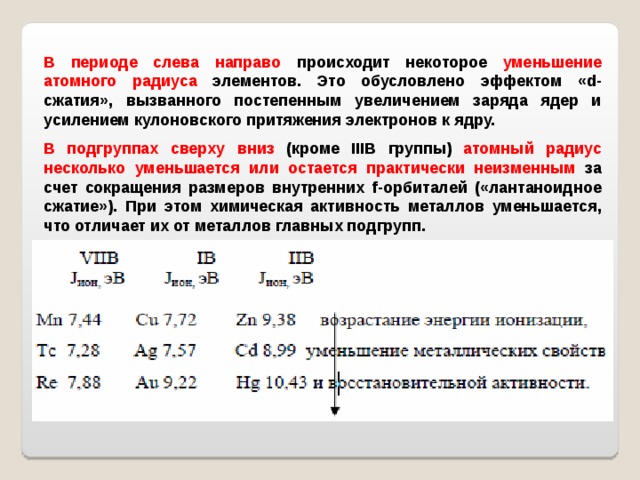
В периоде слева направо происходит некоторое уменьшение атомного радиуса элементов. Это обусловлено эффектом « d -сжатия», вызванного постепенным увеличением заряда ядер и усилением кулоновского притяжения электронов к ядру.
В подгруппах сверху вниз (кроме IIIB группы ) атомный радиус несколько уменьшается или остается практически неизменным за счет сокращения размеров внутренних f -орбиталей («лантаноидное сжатие»). При этом химическая активность металлов уменьшается, что отличает их от металлов главных подгрупп.
У элементов III В группы атомные радиусы возрастают , химическая активность увеличивается, благодаря чему они проявляют большее сходство с элементами главных подгрупп, чем побочных. По реакционной способности элементы подгруппы скандия уступают лишь щелочным и щелочноземельным металлам.
В периодах слева направо металлические свойства уменьшаются.
Минимальные восстановительные свойства проявляют тяжелые металлы VIIIB и IB – групп. За свою инертность они названы благородными.
В химических реакциях электроны d-орбиталей участвуют после того, как оказываются использованными s-электроны внешнего энергетического уровня.
В образовании связей могут участвовать все или только часть d-электронов предпоследнего энергетического уровня, поэтому образуются соединения с различной валентностью или степенью окисления (кроме d-элементов II и III групп).
Например, характерными для элементов VIII В группы являются следующие степени окисления (в скобках – наиболее устойчивые):
Fe Co Ni семейство железа
Ru Rh Pd легкие платиновые металлы
О s Ir Pt тяжелые платиновые металлы
особенностями электронного строения d-элементов обусловлены и их свойства:
а) большое разнообразие проявляемых валентностей и степеней окисления;
б) способность образовывать различные комплексные соединения;
в) каталитическая активность.
Физические свойства d- металлов
Физические свойства переходных металлов зависят от электронного строения, от числа неспаренных d-электронов, которые могут участвовать в образовании связей.
- Металлы, у которых по3–4 неспаренныхd-электрона (VВ и VIВ группы), имеют максимальную температуруплавления и кипения.
- Переходные металлы, имеющиена внешнемs-подуровне один электрон, как правило, имеют более высокую электрическую проводимость (Cr, Мo и особенно Cu, Ag, Au).
- Элементы III-В группы,имеющие всегоодин d-электрон, по своим свойствам близки к соседнимщелочноземельным металлом,
- а металлы II-В группыс полностью заполненным d-подуровнемблизки по свойствам к соседним р-элементам.
Химические свойства d -металлов
Все d-элементы являются восстановителями. Восстановительная способность в растворах в пределах периода уменьшается.
Наиболее сильными восстановителями являются металлы IIIВ группы.
У большинства d-элементов образуются защитные оксидные пленки , вызывающие их пассивацию и предохраняющие их от коррозии. Наиболее склонны к пассивации металлы IVВ–VIВ групп.
Элементы IIIВ и IIВ групп (кроме ртути) легко взаимодействуют с разбавленными кислотами, а лантан взаимодействует и с водой.
Не взаимодействуют с разбавленными кислотами металлы IВ группы, ртуть и платиновые металлы (Ru, Rh, Pd, Os, Ir, Pt).
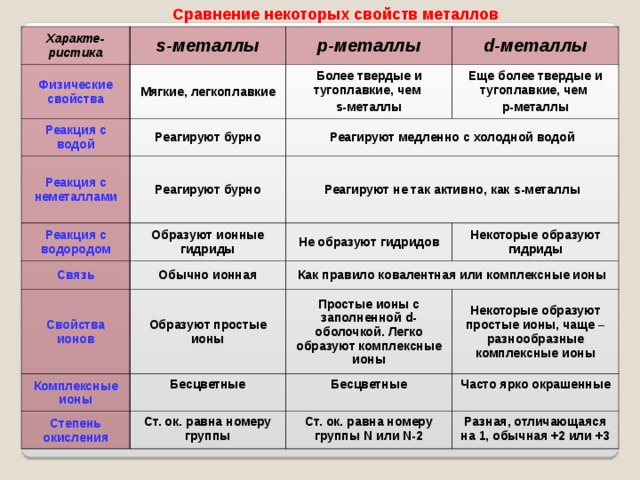
Сравнение некоторых свойств металлов
Реакция с водой
Более твердые и тугоплавкие, чем
Реакция с неметаллами
Еще более твердые и тугоплавкие, чем
Реагируют медленно с холодной водой
Реакция с водородом
Реагируют не так активно, как s -металлы
Образуют ионные гидриды
Не образуют гидридов
Как правило ковалентная или комплексные ионы
Некоторые образуют гидриды
Образуют простые ионы
Простые ионы с заполненной d- оболочкой. Легко образуют комплексные ионы
Некоторые образуют простые ионы, чаще – разнообразные комплексные ионы
Ст. ок. равна номеру группы
Часто ярко окрашенные
Разная, отличающаяся на 1, обычная +2 или +3
Строение и свойства соединений d -элементов зависят от степени окисления металла
Степень окисления элемента
Оксиды и гидроксиды d -элементов
Переходные металлы реагируют с кислородом, образуя оксиды ( искл . Ag, Au) . Почти все они нерастворимы в воде, черного или иного цвета. Обладают заметной ковалентностью связей.

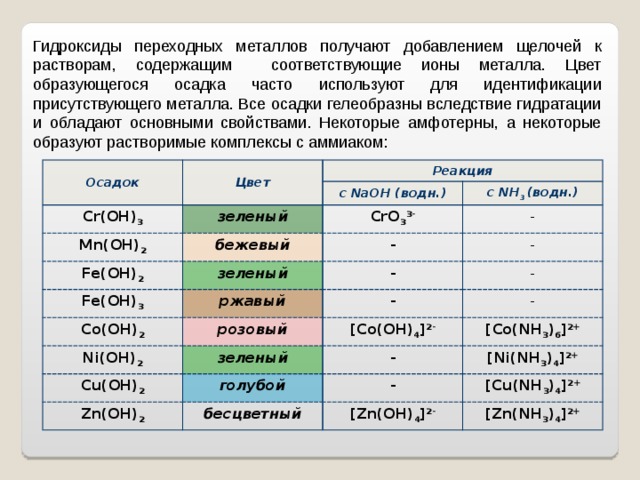
Гидроксиды переходных металлов получают добавлением щелочей к растворам, содержащим соответствующие ионы металла. Цвет образующегося осадка часто используют для идентификации присутствующего металла. Все осадки гелеобразны вследствие гидратации и обладают основными свойствами. Некоторые амфотерны, а некоторые образуют растворимые комплексы с аммиаком:
Презентация по химии » Металлы побочных подгрупп» ( аудитория 9,11 классы)
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Рабочие листы и материалы для учителей и воспитателей
Более 2 500 дидактических материалов для школьного и домашнего обучения
311 лекций для учителей,
воспитателей и психологов
Получите свидетельство
о просмотре прямо сейчас!
Описание презентации по отдельным слайдам:
Металлы побочных подгрупп
11класс
Объясни ответ!
1) Какой элемент с точки зрения строения атома наиболее существенно отличается от трех остальных:
а) алюминий б) железо
в) кальций г) калий?
Важной особенностью атомов d-металлов является наличие свободных орбиталей (на (n — 1)d -, ns — образованию и nр-подуровнях), что позволяет им образовывать донорно-акцепторные (координационные) связи с различными донорами неподеленных электронных пар (молекулы NH3, Н2O, ионы ОН-, CN- и др.).
Вследствие этого d-металлы образуют многочисленные и разнообразные комплексные соединения; например:
В свободном состоянии d -металлы (как и вообще все металлы) являются восстановителями. Восстановительная активность различных d — металлов изменяется в широких пределах: среди них есть металлы средней активности, находящиеся в ряду напряжений до водорода (Fe, Cr , Zn , Mn и др.); малоактивные металлы (Сu, Нg и др.) и благородные металлы (Au , Pt и др.), располагающиеся в ряду напряжений после водорода.
Железный век продолжается …
90% всего
количества
металлов и
металлических
сплавов
приходится на
железные
сплавы.
21.04.2022
15
FeO — основной оксид
Fe2O3 — при высокой температуре амфотерный
FeCl3 + 3KOH →Fe(OH)3↓ +3KCl
FeCl2 + 2KOH →Fe(OH)2↓ +2KCl
4 Fe(OH)2↓ + О2 +2Н2О →4 Fe(OH)3↓
на воздухе окисление идет
бурого цвета
Зеленого цвета
Исследование.
Опыт 1: Свойства соединений хрома.
В пробирку с раствором соли хрома Сr(NО3)3 прибавить по каплям раствор NaОН до образования осадка. Полученный осадок разлить в две пробирки. В одну из них прилить раствор серной кислоты или соляной, а в другую NaОН. Что наблюдается?
Напишите уравнения следующих реакций:
1.Сr(NO3)3 c NaOH
2.Cr(OH)3 с серной кислотой
3.Сr(ОН)3 с избытком NaОН
Опыт 2: Окислительные свойства дихроматов.
К раствору К2Сr2O7 прибавить раствор серной кислоты, а затем раствор сернисто-кислого натрия (Na2SО3). Наблюдать изменение окраски. Написать уравнение окислительно – восстановительной реакции.
Опыт 3: Перевод хроматов в дихроматы.
К раствору К2СrO4 прибавить раствор серной кислоты. Наблюдать изменение окраски. К полученному раствору прибавить гидроксид натрия или калия. Наблюдать изменения окраски. Записать наблюдения и уравнения реакций.
Опыт 4.исследование К2Cr2О7 К насыщенному раствору добавьте конц. Серной кислоты. Реакция охлаждается снегом. Обратите внимание на выпадения кристаллов CrO3. Запишите уравнения и признаки реакции.
Задания:
1.Объясните, почему в одном случае соль, содержащая хром, изменяет окраску, лакмуса в красный цвет, а в другом в синий.
2. Почему ион Cr+2 является восстановителем, а ион Cr+6 — окислителем.
Задача: Какой объём 5,6% р-ра едкого кали ( пл. 1,05 г/мл) необходим для полного растворения 1,5 моль осадка гидроксида хрома (III) с образованием кислой соли.
Самостоятельная работа на 6 мин.
!)В химии для обнаружения иона Fe+2 в растворе используют реагент, формула которого:
а) NaOH; б) K2SO4; в) окраска цвета пламени.
2) Вычислите объем газа (н.у.), который образуется при растворении железа в 8,1 г раствора бромоводородной кислоты содержащей 20% бромоводорода.